�@���̃y�[�W�������������������̃o�[�W�����������p�������B�u���E�U�[�ł͌��ɂ����̂ł����}�̈���͑N���ł��B
�@�]��_�o�n�͕��G�ł킩��ɂ����튯�����A�_�o�זE�̓����͏����������Ă����B���ł�������`���_�o�M���̃��J�j�Y���͍������Ȃ�ǂ������Ă���B���������Z�����ł͂�����Ɛ�������Ă��Ȃ��B���̂������B.Alberts �������u�זE�̕��q�����w�v�AD.L.Nelson�������u���[�j���W���[�̐V�����w(��R��)�v�AJ.Darnell�������u���q�זE�����w�v�����Q�Ƃ��Đ������܂��B�����̖{���͍��Z�����ŏK�����t�R���f���T�[�̗��_�ł��B
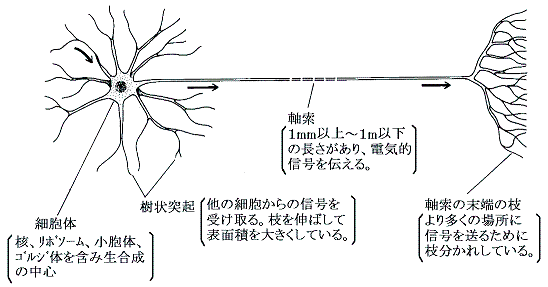
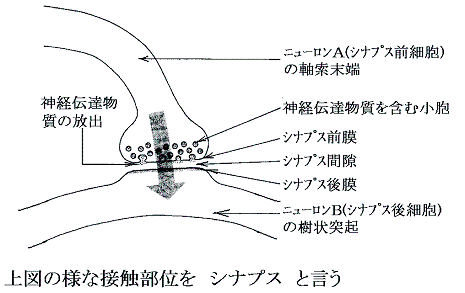
�@�ŏ��ɐ_�o�זE�ɂ��ĕ��K����B�ꏊ�ɂ��`�͂��Ȃ�قȂ邪�A�ȉ��̂S�̕�������Ȃ鎖�͋��ʂ��Ă���B

�@�_�o�זE�������̖��[�̎}���V�i�v�X�ƌĂ�錋�����ʂ�ʂ��đ��̍זE���זE��������ˋN�ɐM���𑗂�B��R�̍זE����̐M��������ˋN��ʂ��Đ_�o�זE�̍זE�̂ɑ�����B�����̐M���̏W�����̂�����臒l���z����������ɐM��������o����A�����̖��[�̎}�Ɍ������ĐM�����`�B����Ă����B�����Ď����̖��[�̎}�͑��̐_�o�זE�̍זE�̂����ˋN�ƃV�i�v�X�������Ă��āA����ɑ��̍זE�ɐM����`����B
�@�����̖��[�̎}�Ǝ���ˋN�Ƃ̐ڍ������V�i�v�X�Ƃ����B����͓d�C�I�V�O�i�������w�I�V�O�i���ɕς��A���������ɂ�����x�d�C�I�V�O�i���ɑւ���B���w�I�V�O�i���̓V�i�v�X�Ԍ��Ɏ�X�̉��w���������o����邱�Ƃɂ��B�������B
�@�����A�L����w�K�͎���ˋN�⎲���̖��[�̎}���L�тĂ����V�����זE�Ƃ̃V�i�v�X�����������Ă������ƁA����уV�i�v�X�̓`�B���\���ω����邱�Ƃɂ���������Ă���ƍl�����Ă���B�����������ω���_�o�זE�̉Y���ƌ����B
�@�����Œ��ӂ��ׂ����́A�_�o�זE���g�͐��܂ꂽ���ɂ��ׂď������I����Ă���A����Ȍ�͍זE��������Ă��̐���������ƌ������Ƃ͖������ł���B����͋L����w�K�̃��J�j�Y�����l����Γ��R�̂��Ƃł���B������������������ߒ��ŏ�L�̉Y���̒~�ςɂ��l�X�ȋL����w�K��������ɍזE���N�����Ă��܂��ƁA����܂ō\�z���ꂽ�_�o�זE�̃l�b�g���[�N�����Ă��܂����ƂɂȂ邩�炾�B
�@�����琶�܂ꗎ������ɐ_�o�זE�̐��������邱�Ƃ͂Ȃ��B���ł��A���čs�������ł���B�����̊w�K�́A���̎��ł�j�n���I�ɃR���g���[������邱�Ƃɂ��_�o�זE�̃l�b�g���[�N�����o����Ă������Ƃɂ���ĒB�������ƍl�����Ă���B
�@�ȉ��ŕK�v�ɂȂ�̂Ŗ��̗����ŃC�I���d�ׂ̃o���X������Ă���ꍇ�ɐ����邱�Ƃ�_���Ă����B
�@���d�ʂ�������C�I���́A���̔��Α��ɂ��锽�Γd�ׂ̑C�I���ɓd�C�I�Ɉ������������̂����߂��Ƃ���ɑw���Ȃ��đ��݂��A�����čL��������Ԃő��݂���킯�ł͂Ȃ��B�זE���̕\�w�ȊO�̕����ł͗z�C�I���ƉA�C�I���̔Z�x�͐��m�ɓ������Ȃ��Ă���B
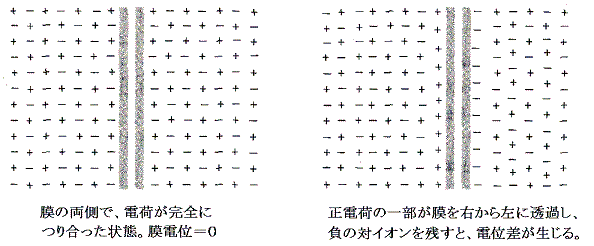
�@����͖����ɍL�������ʂ���l�ɑѓd���Ă���ꍇ�̓d��ɂȂ�B���t�R���f���T�[�̓d�����v���o���B
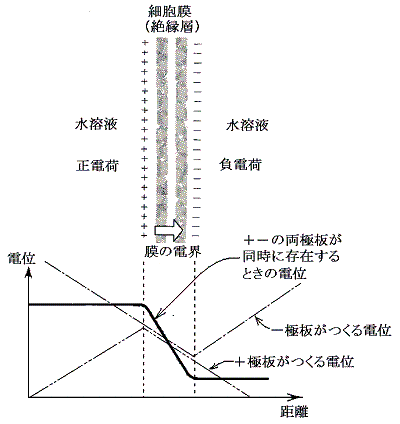
�@�זE���P�����Q���P�~�P�O�|�S���Q������O�D�P�ʂb�̓d�ׁi�O�D�P�~�P�O�|�U�m�b�n�^�P�D�U�~�P�O�|�P�X�m�b�^�n����U�~�P�O�P�P�m�n����P�~�P�O�|�P�Q�m�������n�̃C�I���j�����̔��Α��Ɉڂ�ƁA��O�D�P�{���g���P�O�O���u�̓d�ʍ���������B����͍זE���P�����Q������P�ʂe�̓d�C�e�ʂ������Ƃ��Ӗ�����B�i�b���p�^�u���O�D�P�m�ʂb�n�^�O�D�P�m�u�n���P�m�ʂe�n�j
�@���̒l����v�Z����ƁA���a�P�ʂ��̎����Ŗ��̓d�ʂ��P�O�O���u���O�D�P�u�ς���̂ɕK�v�Ȃj�{�C�I���̗��o�ʂ͎��������ɑ��݂���j�{�C�I���̖�P�����̂P�ł����B����͔��ɑ�Ȏ����ł���B�זE���O�̂m���{�Ƃj�{�̔Z�x�̂������ʂ��ړ�������ΐM����`�B���邽�߂ɕK�v�Ȗ��d�ʂ���̂ŁA�זE���d�C�I�ɘA���I�Ȋ��������Ă���Ƃ��ł��A�����O�̂m���{�Ƃj�{�̃C�I���Z�x�͂������ł���Ƃ��ėǂ��B���ۂm���{�|�j�{�|���v���Ȃ����Ă��A���̌㉽�����̊����d�ʂ�`���ł���B
�@�ʏ�̍זE�ł͂Q�D�i�P�j�ŏq�ׂ��m���{�|�j�{�\���|���v��A���I�ɓ����������邱�Ƃɂ��m���{�Z�x�͍זE�O�łS�~�P�O�Q�������^���R���x�A�זE���ł͂��̂P�O���̂P���x�ɁA�j�{�Z�x�͍זE�����S�~�P�O�Q�������^���R���x�ŁA�זE�O�͂��̂Q�O���̂P���x�̔Z�x�ɒ�������Ă����B���܂j�{�C�I�����ړ�����ꍇ�ŏ�L�̌��_�����ς����Ă݂�B

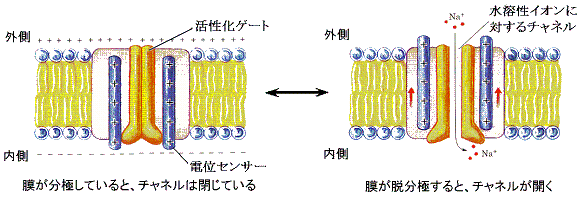
�@������`���d�C�M���`�B���J�j�Y���Ŗ{���I�ȓ���������̂��ȉ��ɏq�ׂ�3��ނ̃C�I���`���l���ł���B��������������\������זE���ɖ��ߍ��܂ꖌ���ђʂ��Ă���B
�@�\���^�Ƃ͔Z�x���z��d�ʂ̌��z�ɋt����ăC�I�����ړ��ł���^�C�v���Ӗ����G�l���M�[�������B
�@�^�Ƃ͔Z�x���z��d�ʌ��z�ɂ����������g�U�ɂ���ăC�I���߂�����^���Ӗ�����B���̃^�C�v�̓G�l���M�[�͕K�v�Ƃ��Ȃ����`���l�����J���ɂ͉��炩�̂����������K�v�ȃ^�C�v�i�R�j�ƁA�����J���Ă���^�C�v�i�Q�j������B�ǂ���ɂ��ʉ߂�����C�I����̓��ِ��͂���B
�@����͂`�s�o�Ƃ��������ȕ��q�ɒ~����ꂽ�G�l���M�[������āA�Z�x���z�ɋt����ăC�I�����^������B�m���{���זE�O�ɁA�j�{���זE���ɓ����B���̂Ƃ��זE�O�͂m���{�ɕx�A�זE���͂j�{�ɕx�ނ���Z�x���z�ɋt����ĉ^�����邱�ƂɂȂ�B�܂��m���{�͌�Ő�������d�����z�i���O�����d�ʁj�ɂ��t����ĉ^�������B���̂��߂��̃|���v�����ɂ̓G�l���M�[���K�v�ł���B���̃G�l���M�[�͂`�s�o�Ƃ������G�l���M�[���q���z�E�������ĕ₤�B
�@���̍쓮���J�j�Y���͕��G���I���ł���B���̓�����͎��}�Ő�������B�|���v�͂`�s�o����O�ꂽ���G�l���M�[�����_���������邱�Ƃɂ��`���a�̍\���ω�����B���̍\���ω��͂m���{��j�{�̋z���T�C�g�̍\���ω��ݏo���B���̂��߁A���̋z���T�C�g�̃C�I���z�����ɕω��������m���{�̗��E�A�j�{�̋z����������B���̂Ƃ��j�{�̋z��������Ȃ�\���ω��������N���������_�̒E���������N�����B���̒E�����a���`�ւ̍\���ω��ƃC�I���z���T�C�g�̍\���ω��ݏo���B���̂��߂j�{�����E���A�m���{���z������B���̕ω����Ăу����_�̋z����U�����čŏ��̂`���a�\���ω���U������B�ȉ��`�s�o�A�m���{�A�j�{�C�I����������肱�̕ω����J��Ԃ��C�I�����^�����ꑱ����B

�@���ۂ̃|���v�ɂ͂m���{�C�I���̋z���T�C�g�͂R�����A�j�{�C�I���̋z���T�C�g�͂Q��������A�`�s�o���q�P�̏���ɂ���A�̂`���a���`�\���ω��łR�̂m���{���O�ɁA�Q�̂j�{�����ɓ����ɉ^�������B
�@�����זE�͂��̃|���v����ɓ������Ă���A�זE���O�ɂm���{�Ƃj�{�̔Z�x���z�������Ă���B���̔Z�x���z�͎��
�̓��������邪�A�����ł��P�D�d�ʍ�������������p�����B�����זE�̃G�l���M�[����̂P�^�R�ȏオ���̃|���v�̍쓮�ɔ�₳���B�܂��_�o�זE�ł́A�זE����G�l���M�[�̂V�O�������̃|���v�ɔ�₳���B
�@�זE���ɖ��ߍ��܂�āA��ɓ��������Ă���m���{�|�j�{�\���|���v�ɂ��A�זE�O�͂m���{�C�I���������A�זE���͂j�{�C�I����������Ԃɕۂ���Ă���B���̂Ƃ��m���{�Z�x�͍זE�O�łS�~�P�O�Q�������^���R���x�ł���A�זE���ł͂��̂P�O���̂P���x�ł���B�j�{�ɂ��Ă͍זE�����S�~�P�O�Q�������^���R���x�ł���A�זE�O�͂��̂Q�O���̂P���x�ł����B���̂Ƃ��A���C�I���Z�x�͖��̗����œ������B�܂����C�I���Z�x�����̗����œ������B�����Ă��ꂼ��̑��Ő��C�I���ƕ��C�I���̐��̓g�[�^���̓d�C�ʂ��[���ɂȂ�悤�ɐ��m�ɂ荇���Ă����B���̏�ԂŁA���ɏq�ׂ�j�{���[�N�E�`���l�����͂m���{���[�N�E�`���l�������݂���Ƃǂ̗l�Ȏ����N���邩�l���Ă݂�B
�@�C�I���͍זE����ʉ߂��邱�Ƃ͂ł��Ȃ��B���[�N�E�`���l���Ƃ͍זE���ɍE���J���Ă���p�C�v�ł���B���������̌��̑傫���A�`�A���̓��ʂ̕��q�̈Ⴂ�ɂ�蓧�ߐ����C�I����Ɉˑ�����B�j�{���[�N�E�`���l���Ƃ͎�ɂj+�C�I�����A�m���{���[�N�E�`���l���Ƃ͎�ɂm���{�C�I�����ʂ��₷�������Ǝv���悢�B
�@�C�I�����I�����郁�J�j�Y�����ۂ��j�{�`���l�����Ƃ��Đ�������B���̃`���l���͉��}�̂悤�ɂW�{�̖����ђʂ��钷�����փ��b�N�X�ƂS�{�̒Z�����̂Ƃō\�������B�זE�����̍E�͍L���C�I���͐��a�w��ێ������܂܃`�H�l�����ɓ���B
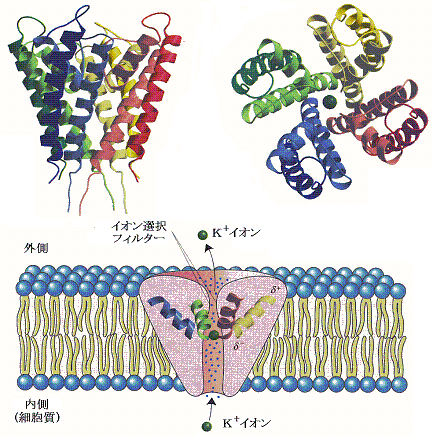
�@�`���l���̓����ɂ������̕��ɉדd�����A�~�m�_�c����݂����C�I���Z�x�����߂Ă���B�`���l�����ɓ��������C�I���͒Z���փ��b�N�X�̓d�ׂɂ����o����I���t�B���^�[�̓����܂ň�������B�I���t�B���^�[�͍E�ɂȂ��Ă�������ɑ��݂���J���{�j����̎_�f�Ɛ��C�I�����z�ʌ���������B
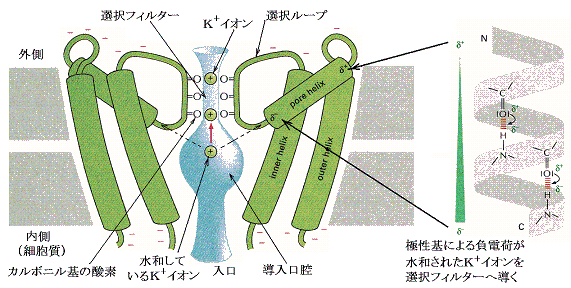
�@�j�{�C�I���i���a0.133�����j�Ƃm���{�C�I���i���a0.095�����j�ł͂��̑傫�����Ⴄ���߁A�m���{�C�I���͍E���ň���Ȍ�����Ԃ����邱�Ƃ��ł��Ȃ��B�i���}�Q�Ɓj
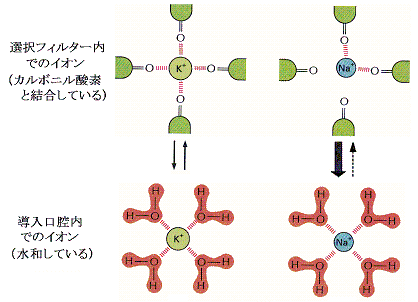
�@�j�{�C�I���͐��a��Ԃ̃G�l���M�[�ƃJ���{�j���_�f�ƌ�����Ԃ̃G�l���M�[���قړ��������߁A���a�w������Ȃ蔍������E�ɓ����Ă����邪�A�m���{�C�I���ł͐��a��Ԃ̕������|�I�Ɉ���ōE�ɓ���Ȃ��B�i���̑I�����J�j�Y����1998�N��Roderic MacKinnon���ɂ��𖾂��ꂽ�B�ނ͂��̌��т�2003�N�m�[�x�����w�܂���܁j
�@�`���l�����̂j�{�C�I���̔z�u�Ԋu�͏�}�i�I���t�B�^�[�̗��[�Ɍ݂��ɖ�0.75��������đ��݁j�̗l�ł���A�E���̂Q�̂j�{���m�̐Ód�I�Ȕ����͂��j�{�̍E����̗��E�������Ă���B
�@�j�{�C�I���̕����m���{�C�I�����P���{�ȏ㓧�ߐ����悭�A�P�b�������P�O�W�����߂ł���B���̃C�I�����ِ��`�����l�������l�ȃ��J�j�Y���œ����Ă���炵���B
�@���̃^�C�v�̃`���l���͂����̌�������A�Z�x�̔Z�������甖�����֊g�U�ɂ���ĘR��o�Ă����B�R��o�Ă����`���l�������烊�[�N�E�`���l���ƌ�����B���̂Ƃ��Z�x�����傫���قǒP�ʎ��ԂɘR��o��ʂ͑����Ȃ�B�O�L�i�P�j�̔\���|���v���������Ă���ɁA���[�N�E�`���l���������Ƃǂ̗l�Ȏ����N���邩���Ă݂悤�B
�@�j�{���[�N�E�`���l�����������݂���Ƃ���ƁA���Z�x�̍זE�̓�������O���ւj�{�C�I���͘R��o�Ă����B���̂Ƃ��A���̃C�I���͈ړ��ł��Ȃ��̂ŁA�זE�O�Ł{�C�I���i�j�{�j���A�זE���Ł|�C�I�����ߏ�ɂȂ�B�ȑO�q�ׂ��悤�ɁA�����̉ߏ�C�I���͍זE���̂����\�ʂɑw��ɕ��z���Ĉ��̕��t�R���f���T�[���`�����A���̗����ɓd�ʍ�����B�����d�ʍ��͂j�{�C�I���˕Ԃ������̓d����邩��₪�Ăj�{�C�I���̘R�o�͎~�܂�B�܂�A�`���l���͊J�������ɂ�������炸�j�{�C�I���̔Z�x���z�ɑR���邾���̓d�ʌ��z�ɂȂ�ƕ��t��Ԃ���������Ăj�{�C�I���̘R�o�͂Ƃ܂��킯���B���̓�������������̂����}�ł���B���̕��t��Ԃɂ�����d�ʍ��́A�|�V�O���u���x�ł���B

�@�m���{���[�N�E�`���l�����������݂���Ƃ���ƁA���Z�x�̍זE�̊O����������ւm���{�C�I���͗�����������B���̂Ƃ��A���̃C�I���͈ړ��ł��Ȃ��̂ŁA�זE���Ł{�C�I���i�m���{�j���A�זE�O�Ł|�C�I�����ߏ�ɂȂ�B�����̉ߏ�C�I���͍זE���̂����\�ʂɑw��ɕ��z���Ĉ��̕��t�R���f���T�[���`�����A���̗����ɓd�ʍ�����B���̓d�ʍ��͂m���{�C�I���˕Ԃ������̓d����邩��₪�Ăm���{�C�I���̗����͎~�܂�B�܂�A�m���{�̔Z�x���z���ʂɑR���邾���̓d�ʂɂȂ�ƕ��t��Ԃ����������B���̓���������}�Ɏ����B���t��Ԃɂ�����d�ʍ��́{�T�O���u���x�ł���B
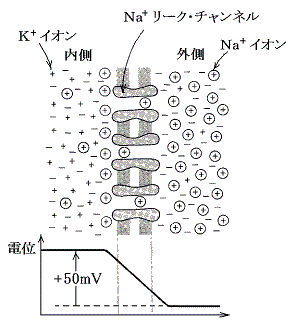
�@�����ňȉ��̎��ɒ��ӂ��ׂ��ł���B�זE���ɂ͂g�o�n�S�Q�|�A�r�n�S�Q�|�A�l���Q�{�A�b���Q�{�Ȃǂ̃C�I�������݂��邪�A�����̃C�I����ʂ����[�N�E�`���l���͂قƂ�Ǒ��݂��Ȃ��̂ł����ł͍l���Ȃ��ėǂ��B���d�ʂ̌`���ɊW����C�I���͂m���{�A�j�{�A�b���|�A�ł��邪�A�����̃C�I����ʂ����[�N�E�`���l���̒��łj�{���[�N�E�`���l�������ʖL�x�ɑ��݂��j�{�����̂��̂��P�O�{���炢�ʂ�₷���B���̂��߁A���ۂ̐_�o�זE���ł��j�{���[�N�E�`���l�����������݂����ƍl���ėǂ����Ƃł���B���̂��ߐ_�o�זE���ł͂P�D�i�S�j�Ő��������������A�j�{���[�N�E�`���l�������镽�t�d�ʂɋ߂��Ȃ�A�O���̓d�ʂ���O�{���g�Ƃ���ƁA�����͖�|�U�O�`�|�P�O�O���u���x�ɂȂ��B
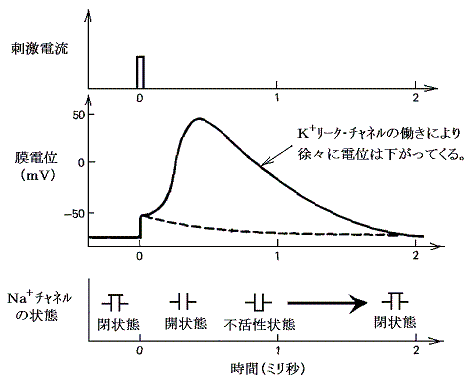
�i�P�j�ŏq�ׂ��m���{�|�j�{�|���v�ƁA�i�Q�j�ŏq�ׂ��j�{���[�N�E�`���l���ɂ��ȉ��̏���������Ă���B
���̂Ƃ����ɏq�ׂ�^�C�v�̃`���l���������ƁA�ǂ̗l�Ȏ��������邩�l���Ă݂�B
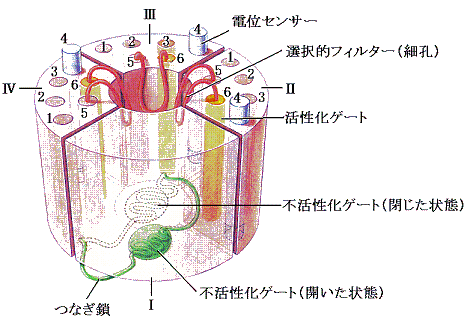
�d�ʌ^�`���l���Ƃ́A�����O�̓d�ʍ��̕ω��ɉ������ĊJ����������肷����̂ł���B
�d�ʌ^�m���{�`���l��
�@���̃^�C�v�̃`���l���́A�זE���̓d�ʂ��|�V�O���u�̏ꍇ�͕��Ă���B�������E���Ɂi�זE���̓d�ʂ��O���u�ɋ߂Â��j��������ƁA�������̃`���l���͊J���͂��߂��B��������Ƃm���{�C�I��������ɖ����ɗ��ꍞ�ނ̂ŁA�זE���̓d�ʂ͂���ɏオ���Ă����B���ꂪ��葽���̂m���{�`���l���J����U�����E���ɂ��i�ށB�ŏI�I�ɂ͂Q�D�i�Q�j�m���{���[�N�E�`���l���ŏq�ׂ��̂Ɠ������J�j�Y���ɂ��m���{���t�d�ʂł���{�T�O���u�ɒB����܂ő����B�m�m���{�`���l���������ɕ��Ă��܂�(��Ő���)�n���Ƌy�ёO�L���m�m���{���t�d�ʂ��B�������n���Ƃɂ��m���{�C�I���̗����͎~�܂�B
�@�����Œ��ӂ��ׂ����́A�d�ʂ��O���u�ȏ�̏�Ԃł��d�ʌ^�m���{�`���l���́A���̃��J�j�Y���ɂ��A�����ɕ��Ă��܂��A�d�ʕω��ɑ��鉞�����������Ă��炭�̊ԕs������Ԃ��������Ƃł���B�����Ăm���{�`���l�����E���ɂɑ��ĉ����s�̊ԂɁA���ɏq�ׂ�d�ʌ^�j�{�`���l�����J���זE���̂j�{�C�I�����זE�O�ɗ��o���čזE���̓d�ʂ��|�V�O���u�ɉ��Ă��܂����Ƃł���B���̓d�ʂ͓d�ʌ^�m���{�`���l�����d�ʕω��ɑΉ��\�ɂȂ��Ă������܂܂ł���l�ł���B
�@
�@�ǂ������炱�̂悤�Ȑ����̃`���l���������ł��邾�낤���B���̓��͈ȉ��̗l�Ȃ��̂ł��邱�Ƃ��ŋ߉����Ă����B�i���[�j���W���[�̐V�����w�m��n��R�ł��j
�@�m���{�`���l���͂P�{�̒����y�v�`�h���ł���A���ꂩ�S�̗̈�i�T�U�V�W�j���`�����Ă���B�����̂S�̗̈悪�����ɍE���\������悤�ɏW�܂��Ă���B�e�̈�ɂ͂U�{�̖��ђʂփ��b�N�X�R�C���i�P�Q�U�S�T�U�j������B
�@�փ��b�N�X�R�C���T�ƂU�̊Ԃɂ���y�v�`�h�i�ԐF�j���זE�O�\�ʋ߂��ŏW�܂�u�E�̈�i�ԐF�j�v�Ƃ����镔�����`������Ă���B������Q�D(�Q)�ŏq�ׂ��j�{���[�N�E�`���l���Ɠ��l�ȃ��J�j�Y���ŃC�I����I�ʂ���t�B���^�[���`������B�����O�L�j�{���[�N�E�`���l���̒����Q�{�̖��ђʌ^���փ��b�N�X�Ƃ��̊Ԃɋ��܂ꂽ�Z���փ��b�N�X�̕��q�\���́A�����ł̂փ��b�N�X�T���E�̈恨�փ��b�N�X�U�̍\���Ƃ悭���Ă���A���ʂ̑c�悩��i���������̂��ƍl�����Ă����B���̂������ŁA�m���{�Ƃ���ȊO�̑傫���̎����C�I������ʂ��邱�Ƃ��ł��m���{�C�I���ɑ��ē��ٓI�ɂȂ��Ă���B
�@�e�̈���փ��b�N�X�R�C���S�i�F�j�ɂ͐��ɉדd�����c������x�ɑ��݂��Ă���B���̂փ��b�N�X�S�͖����O�̓d�ʍ��̕ω��i�|�U�O���u���{�R�O���u�j�ɔ������āA���̒����ړ�����ƍl�����Ă���B���̂悤�Ȃփ��b�N�X�S�̓����ɂ���Ăփ��b�N�X�T�ƂU����������`���l���̊J���������N�������B
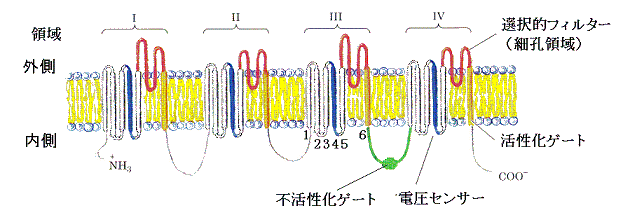
�@�̈�V�ƇW���Ȃ��ł���y�u�`�h�����s�����Q�[�g�i�ΐF�j�ł���B����̓{�[���̂悤�Ȍ`�����Ă��镔�����A�Z���|���y�v�`�h���i�`�F�[���j�ɂ���ă`���l���ɂȂ���Ă���B�{�[���̕����̓`���l�������Ă���Ƃ��͎��R�ɓ����܂��邪�A�`���l�����J���Ă���Ƃ��̓`���l���̍זE�����̕��ʂ��{�[���ƌ�������̂Ń`���l�����Ւf����B�ق��P�����ȓ��ɂ��̕ǂ��N����B�C�I���`���l�����ǂ̂��炢�̊ԊJ����Ԃɂ��邩�̓`�F�[���̕����̒����ɂ���Č��܂�A�`�F�[���������قNJJ�����Ԃ������B�`�F�[�����Z���ƃE���E���ł����ɁA�����ɊJ�����ɂ͂܂��Ă��܂����炾�낤�B��ŏq�ׂ�d�ʌ^�j�{�`���l���ł͗̈�h�A�U�A�V�A�W�̃A�~�m���[�m�g�R�{���̂��ׂĂɃ{�[����̍\���������Ă���A�S�̃{�[�����̈���J�����`���l���Ɍ������ĕs�������Q�[�g�̓���������B
�@�`���l���J�����ɂ͂܂����{�[���́A�����Ăѕ��ɂ����d�ʃZ���T�[�S�i�F�j�̈ʒu�����ɖ߂�A�������Q�[�g�U�i��F�j������ƁA�`���l������O��Ď��R�ɓ������n�ߍŏ��̏�Ԃ�����B
�@�܂����̃^�C�v�̃`���l���͒E���ɂɂ���u�i0.7���b���x�j�J���Ă����ɕ��Ă��܂��B���̏�Ԃł͒E���ɂɑ��鉞�����������Ă���B���炭�i�����b��j���čĂѕ��ɂ����������ƍŏ��̏�Ԃɂ��ǂ�A�E���ɂɑ��鉞�����������B���̂����������P�b�Ԃɓ`�B�ł���_�o�M���p���X�̐��ɂ͏���������B
�@�����O�̓d�ʂ��ω�����ƁA�����ʂɐ��������Ɍ����Ă����փ��b�N�X�S�i�F�j������ɔ������Ĉړ�����B�փ��b�N�X�S�ɂ͐��̓d�ׂ������x�ɑ��݂��Ă���̂ŁA�זE�������̓d�ʂ̎������ֈ������܂�Ă���B�E���ɂ���Ƃ��̈������݂����Ȃ��Ȃ�փ��b�N�X�S���O���ֈړ�����B���ꂪ�������Q�[�g�i��F�j�̍\���ω��������N�����`���l�����J���B�T�O�`�P�O�O���u�̓d�ʍ��͏������悤�Ɏv����������Ȃ������͔��ɔ����i�T�����j�̂ŁA�P����������ɒ����ƂP�O�T�u�^�����Ƃ������ɑ傫�ȓd�E��������Ă������ɂȂ�B
�����̊J�̗l�q��͎����������̂����}�ł���B
�@
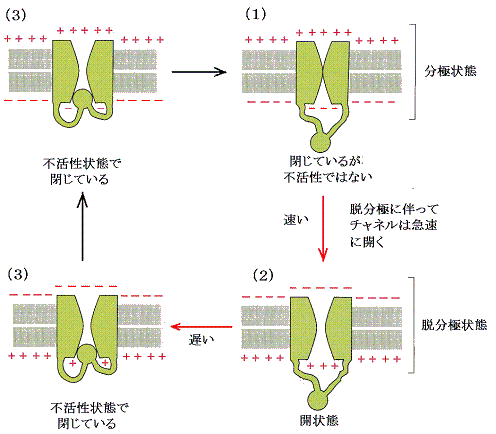
�d�ʌ^�j�{�`���l��
�@���̃^�C�v���d�ʌ^�m���{�`���l���Ɨގ��̕��q�\�����������l�ȃ��J�j�Y���œ����B�܂��E���ɂŊJ���j�{�C�I���̖��O�ւ̗��o���N�����ĕ��ɂ𑣂��B�ĕ��ɂ��B�����ꂽ������B�d�ʌ^�m���{�`���l���Ɠ��l�ȕs��������Ԃ��`������{�[���ƃ`�F�[���̍\����(�S�g�����Ă���)�����邪�A�ȉ��ɐ�������ꍇ�ɂ́A���̕s�������{�[���������O�Ƀ`���l�����̂����Ă��܂��悤�ł���B���������Ĉȉ��̋c�_�ł͂��̃`���l�����s��������Ԃ͖����Ƃ��ċc�_���Ă���B
�@�`���l���J���̉������Ԃ͓d�ʌ^�m���{�`���l���ɔ�r����ƒx���P���b�̉����̈ꂩ�x��ĊJ���B���̂��ߒx���d�ʌ^�j�{�`���l���Ƃ��Ă��B�d�ʌ^�m���{�`���l�����s���������ĕ������ɂj�{�ɑ��閌�̓��ߐ������傷�邱�ƂɂȂ�A�d�ʌ^�j�{�`���l���́A�����v���ɂj�{���t�d�ʁi���̓������|�V�O���u�j�ɂ��ǂ�Î~��ԂɂȂ�̂�������B�i�R�D�i�R�j�Q�Ƃ���j�����Ď������g�����̍ĕ��ɂ����d�ʂɂ����Ă��܂��B
�@
�ȏ�ŏ������������̂ŁA�����ɂ�����d�C�C���p���X���`�B����Ă������J�j�Y�����������B�����ł̖{���͂Q�D�i�R�j�ŏq�ׂ��d�ʌ^�m���{�`���l�����͎��}�Ō����i�P�j�i�Q�j�i�R�j�̎O�̃^�C�v����邱�Ƃɂ���B�ȉ����ꂼ��̃^�C�v���E�̋L���ŕ\���B
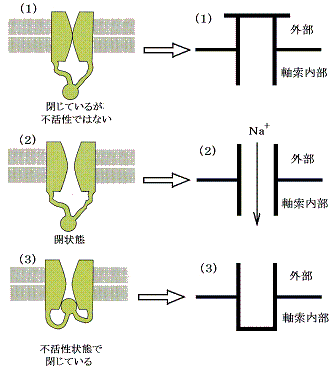
�@�������ɂ킽��v���Ȑ_�o�̒ʐM�͓d�ʌ^�m���{�`���l����p���ď��߂ĒB���ł���B����͎����ɉ����ď\���Ȗ��x�i�~�G������������Ȃ����̂łT�`�T�O�O�^�ʂ��Q�j�Ŗ����ɑ��݂��Ă���A�����d�ʂ̓`�d���ɂȂ��B���̂Ƃ��̖{�����d�ʌ^�m���{�`���l�������Ă���Ƃ��i�P�j�Ɓi�R�j�̓�̃^�C�v������A�i�R�j�̃^�C�v�́i�P�j�̃^�C�v�ƈقȂ薌�̒E���ɂɉ������ĊJ�����Ƃ͂ł��Ȃ��Ƃ���ɂ���B
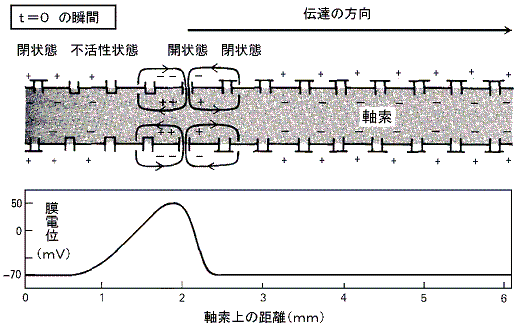
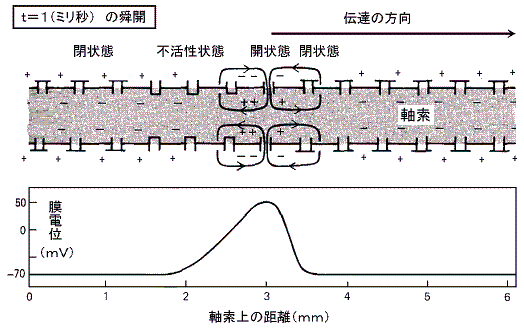
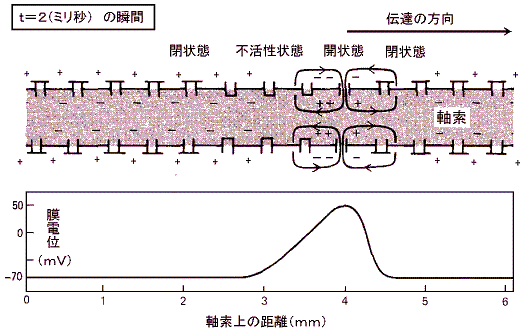
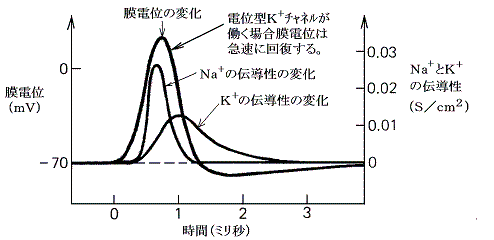
���}�̓C�J�̋���_�o�����̖��t��ԓd�ʂ��狭���I�ɐV�����d�ʂɂ����Ƃ��A����ʉ߂��ė����d���̕ω��̃O���t�ł���B���̐}���疌�d�ʂ̕ω��ɂ��d�ʌ^�m���{�`���l�����A���݂₩�ɊJ���A���̌㏙�X�ɕs����������鎖���ǂݎ���B
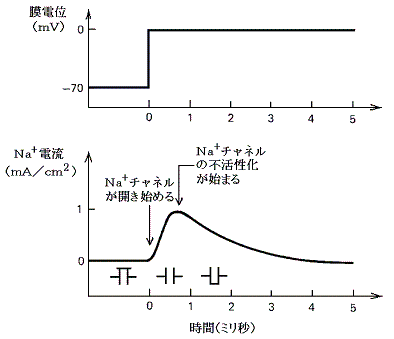
�@���������킸���i�Q�O���u���x�j�E���ɂ�����Z���p���X��d���ɂ��A�����d�ʂ̈��������������B���}�����̃O���t�Ŏ����p�������ꏊ�ɑ��݂���d�ʌ^�m���{�`���l�������X�ƊJ���Q�D�i�Q�j�̂m���{���[�N�E�`���l���̎��ɏq�ׂ̂Ɠ������t���d�ʂɂȂ�܂œd�ʂ̑��傪�i�ށB�������A�₪�ĕs���������n�܂�m���{�`���l���͕��Ă��܂��B�m���{�`���l�������Ă��܂��Ƃj�{���[�N�E�`���l���̓����ɂ�菙�X�ɕ��ɂ����A���Ƃ́|�V�O���u�ɂȂ�B
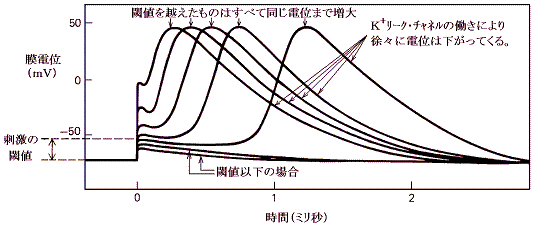
�@�����d�ʂ̈������ƂȂ�̂ɏ\���Ȃm���{�`���l�����J���ɂ́A�ŏ��ɖ�������臒l�i�ՊE�l�j�܂ŒE���ɂ����邱�Ƃ̂ł��閌�d�ʂ̕ω��������Ȃ��Ă͂Ȃ�Ȃ��B����臒l�ɒB����������ΒE���ɂ�����h���̋����͖��ɋN����d�ʕω��̃s�[�N�l�ɂ͊W���Ȃ��B�܂肱�̌n�́A����������������������ƈ������ƂȂ����h���̑傫���ɂ͖��W�Ɍ��܂����O�a��ԁi�Q�D�i�Q�j�ŏq�ׂ��m�{�C�I���̃��[�N�ɔ������t�d�ʂł���{�T�O���u�j�ɒB����B���̑S�������̐����̂������ŁA�V�O�i���������ɂ킽���Ď�߂邱�Ƃ��䂪�߂邱�Ƃ��Ȃ��`���鎖���ł����B
�d�ʌ^�m���{�`���l�������������ꍇ���d�ʂ̉͂j�{���[�N�E�`���l���̓����݂̂ɂ��̂ŁA���̕ω��͂Ȃ��炩�Ȃ��̂ɂȂ�B
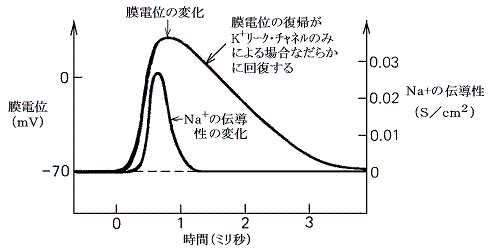
�d�ʌ^�m���{�`���l���ɉ������d�ʌ^�j�{�`���l���i�m���{�`���l����菭���x���j�������ꍇ�͖��d�ʂ̉͋}���ɍs���A���̔g�`�͉s���p���X�^�ɂȂ��B���̂Ƃ��j�{�`���l���̌��ʂ����������߂��āA���ߕ��ɂɂȂ��Ă��邱�Ƃɒ��ӁB
�@���}�̂悤�ɉ��炩�̌����ɂ�肠��d�ʌ^�m���{�`���l�����J���m���{�C�I�����������ɗ�������ƉE�ׂ̓d�ʌ^�m���{�`���l���̈ʒu�ɃC�I�����g�U���Ă����A���̃`���l���̈ʒu��E���ɂ�����B���̂��߉E�ׂ̃`���l�����J���m���{�C�I���𗬓������āA����ɉE�ׂ̃`���l���̊J����U������B�ȉ����X�ɉE�ׂ̃`���l�����J���ēd�ʕω����E�����֓`����Ă����B
�@���̂Ƃ��ŏ��ɊJ�����`���l���͂����ɕs���������āi�R�j�̏�ԂɂȂ�B���̏�Ԃ͂Q�`�R�����̊ԑ����E���ɉ��ł�����ɕ��Ă��邽�߂���Ȃ�m���{�C�I���̗����͎~�܂�B�����ĉE�ׂ̗̈�̒E���ɂɂ���čĂъJ�����Ƃ͂Ȃ��B�����`���l�����i�R�j�̏�Ԃ��o�邽�߂ɓd�ʃp���X�͎����̐�[�Ɍ������Ĉ�����݂̂֓`����Ă����B
�@�d�ʌ^�m���{�`���l�����s���������邱��ɂ́A�Q�D�i�R�j�ŏq�ׂ��d�ʌ^�j�{�`���l���̓����ɂ��j�{�C�I�����������O���ɗ���o�čĕ��ɂ𑣂����t��Ԃ̓d�ʂ�����B���̂��ߓ`�d����d�ʂ͌Ǘ������p���X��̔g�`�i�p���X���P�������x�j�ɂȂ�B
�@�d�ʌ^�m���{�`���l�����s���������Ă���Ԃɓd�ʂ�����B�d�ʂ����Ă���i�R�j���i�P�j�̏�Ԃɕ��A���A���Ȃ�E���ɂ̓�����҂B�ȑO�q�ׂ��悤�ɕs�������̌p�����Ԃ��Z���p�x�ŐM���p���X�𑗂邱�Ƃ͂ł��Ȃ��̂ŁA�p�x�ɂ͏��������B
�@�`�B���x�͐_�o�זE�̎�ނɂ���ĈقȂ邪�P�`�P�O�O�@���^�����x�ł���B�@