このページを印刷される方はこちらのバージョンをご利用下さい。ブラウザーでは見にくいのですが印刷は鮮明です。
ここでは高等学校レベルでの化学結合の本質を述べます。これは前記の万有引力の法則で述べた結論の応用です。
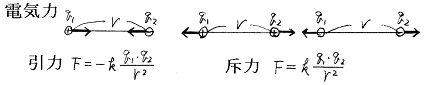
荷電粒子間に働く力は以下に述べるクーロンの法則に従う。

これは電気力のクーロンの法則が距離の二乗に反比例して小さくなる事から来る性質。
証明については「万有引力の法則への補足」を参照せよ。
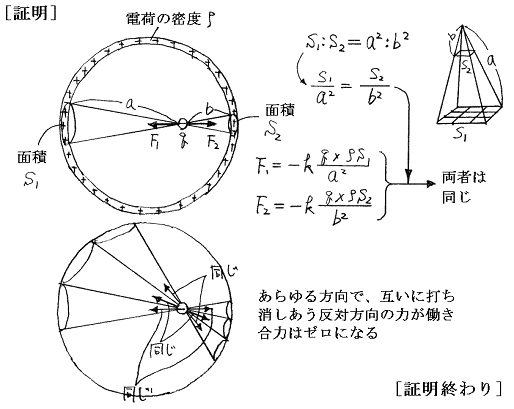
[証明]
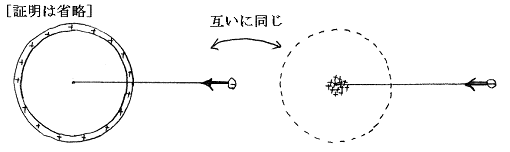
球をタマネギの皮のような多くの球殻に分割して(1)(2)の結論を利用すればあきらか。つまり半径rより外側の部分の電荷が点電荷に及ぼす力はゼロである。又半径rより内側の部分は、中の中心にその部分の電荷を集めたときに点電荷に及ぼす力と同じだけの力を及ぼす。
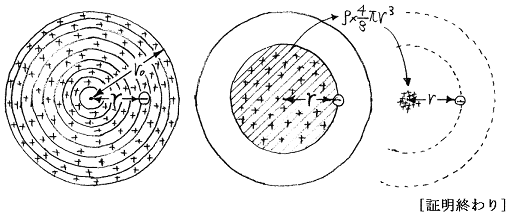
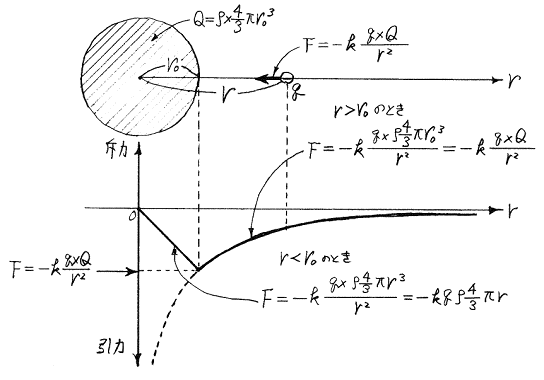
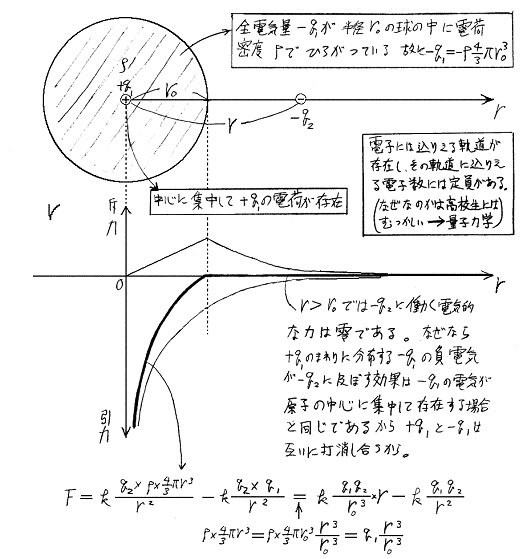
r0>r>0では−q2に働く電気的な力は中心に存在する+q1による引力と半径rの球内に分布する負電荷−ρ×(4/3)πr3による斥力の合力である。半径rの球より外側に分布する負電荷は力を及ぼさない。また半径rの球内に分布する負電荷は原子の中心にそれだけの電荷が存在すると考えて良い。
高校ではなぜそうなのかは論じないが、次に述べる4点が以下の議論に於いて重要になる。
原子核が持つ正電荷(プロトン)の数は原子番号に一致する。原子中心の点状の領域のみに正の電荷が存在する。
電子1個の持つ電荷は原子核を構成する核子(プロトンという)の持つ電荷と、符号は反対だが大きさは同じである。そして普通はプロトンの数と同じだけの電子が原子核の周りを取り巻いている。原子の大きさというのは原子核の周りを取り巻く電子の分布範囲で決まる。
そして各殻のなかに収容できる電子には定員がある。その殻には内側から名前が付いていておりK殻(2個)、L殻(8個)、M殻(18個)、N殻(32個)、O殻(50個)・・・・・・。殻の定員=2n2 (ただしn=1、2、3・・・・・)
だから原子番号(プロトンの数)が増えるにつれて、取り巻く電子の数が増えてくるが、電子はより原子核に近い内側の殻から順番に詰まっていき、その殻の定員が一杯になったら一つ外側の殻に入っていく。
さらに付け加えると電子殻にはさらに微細な構造があり、殻は幾つかの電子軌道(これもおおよそ殻のように分布)からなる。電子軌道の種類にはs軌道(2個)、p軌道(6個)、d軌道(10個)、f軌道(14)、g軌道(18)、h軌道(22)、・・・・・・。軌道の定員=2(2L+1) (ただしL=0、1、2、3・・・・・)
そして各殻に含まれる軌道はK殻(s)、L殻(s、p)、M殻(s、p、d)、N殻(s、p、d、f)、O殻(s、p、d、f、g)・・・・・・である。各軌道の定員を足し合わせると殻の定員になる。K殻(2)、L殻(2+6=8)、M殻(2+6+10=18)、N殻(2+6+10+14=32)、O殻(2+6+10+14+18=50)・・・・・・。
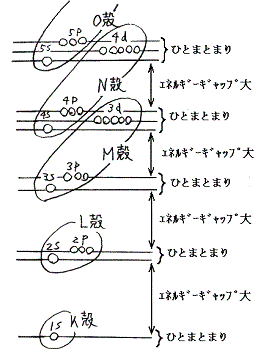
下図はその当たりを模式的に表している。この図で注意すべき事は電子が詰まっていないときには同一エネルギー準位だった各殻中の電子軌道が、電子が詰まっていくに従って分裂していくことである。電子軌道に電子が詰まっていくにつれて電子軌道のエネルギー準位が安定化していく。そのときsやp軌道は急速に安定化して行くがdやf軌道は安定化が遅れて生じる。
そのようになる理由はdやf軌道に比べてsやd軌道がかなり内側まで貫入した軌道部分を持っているからである。貫入部分に落ち込んだsやp軌道の電子については内殻に電子が詰まっていることによる遮蔽効果が有効に効かず、もろに核電荷の引力を受けることになるから安定化するのである。特にs軌道について貫入部分がより深いので安定化の度合いが大きい。一方dやf軌道については貫入部分がないので、内殻電子の遮蔽効果が有効に働き、電子が同一軌道に入ることによる有効核電荷の増大の効果が始まるのを待って安定化が始まる。
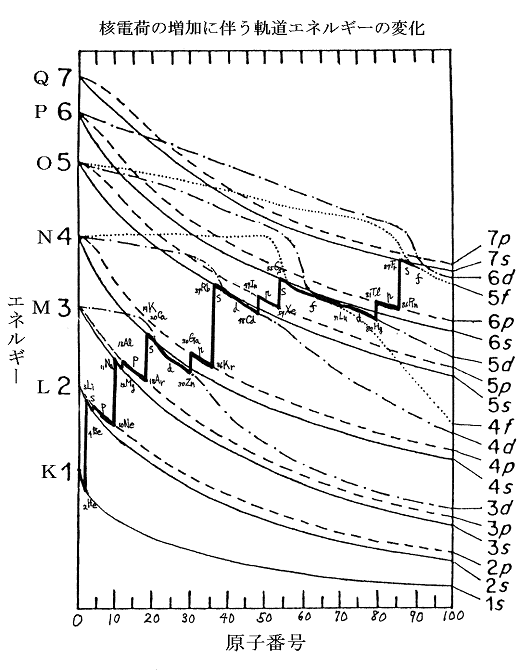
このようにして殻を構成する軌道のエネルギー準位が変化する。そのため、電子が満たされつつある軌道のエネルギー準位のレベルで考えると以下の様になる。殻の一部の円錐領域を切り取った下図はその当たりを模式的に表している。
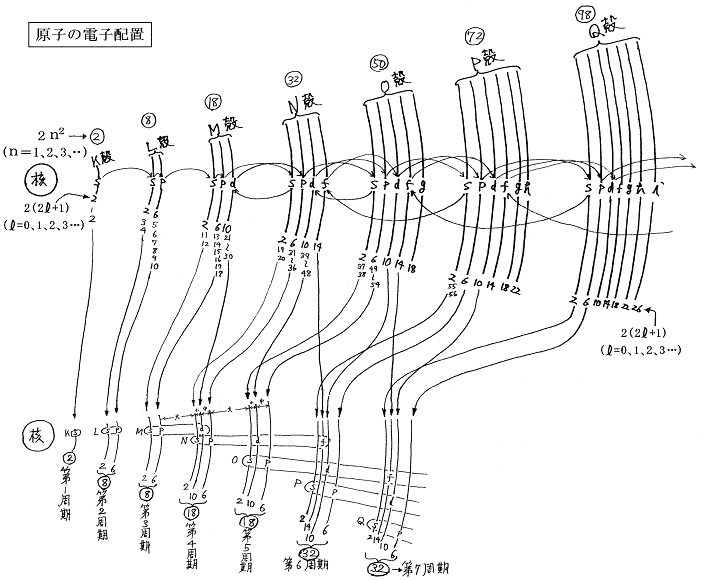
この図で注意すべき事は、電子構造がK、L、M、・・・・殻の固まりとその間のエネルギーギャップの存在で構成されているのではなくて、1s、2s2p、3s3p、4s3d4p、5s4d5p、6s4f5d6p、7s5f6d7p、・・・・の固まりと、それらの間のエネルギーギャップの存在で構成されている事である。
さらに注意すべきは、K殻の1sより外側の殻構造では、それぞれの固まりの中でs軌道のエネルギー準位が一番低く殻の内側を、p軌道のエネルギー準位が一番高く殻の上面を構成していることである。そのためp軌道が満たされた希ガスの電子配置が特別に安定になる。(6.なぜ希ガスの電子配置を取ると化学的に安定なのかを参照せよ)
もう一つ注意すべき事はsfdとpの間にエネルギーの小ギャップが存在することである。このためp軌道に電子が詰まりつつある元素は、内殻の電子構造にほとんど影響されることなく化学的性質が決まる。p軌道の電子数により性質が決まるので族ごとに似た性質を示し典型元素といわれる。
このことから周期律表の第1周期、第2周期、第3周期、・・・・を構成する原子数が2、8、18、32、50、・・・・・ではなくて2、8、8、18、18、32、32、・・・・・となることが説明できる。(下図参照 周期律表)
正電荷のプロトンがなぜ反発力で飛び散らないで原子核という狭い領域に閉じこめられているのか?、正電荷の原子核と負電荷の電子が、なぜくっついてしまわないのか?、なぜ電子は重層的に重なった殻に収納されるようにして原子核にまとわりつくのか?、なぜ各殻が収容できる電子数に定員があるのか?等々・・・・非常に不思議な事だが、高校ではすべて天下り的に成り立つものとして論じる。この所を天下り的に認めてしまえば、前述の1.逆二乗法則に従うクーロン力の性質によって、高校レベルで習う化学結合の本質はすべて理解できる。
イオン化エネルギーとは[中性の原子が持つエネルギー]と[中性の原子から1個の電子がはずれて+1価のイオンとなったとき、その+1価のイオンと外れた電子が無限に離れて存在する状態でのエネルギー]との差のことである。イオンとなったものからさらに電子がはずれる場合にも同様な方法で定義される。当然電子が外れた状態のエネルギーが高い。
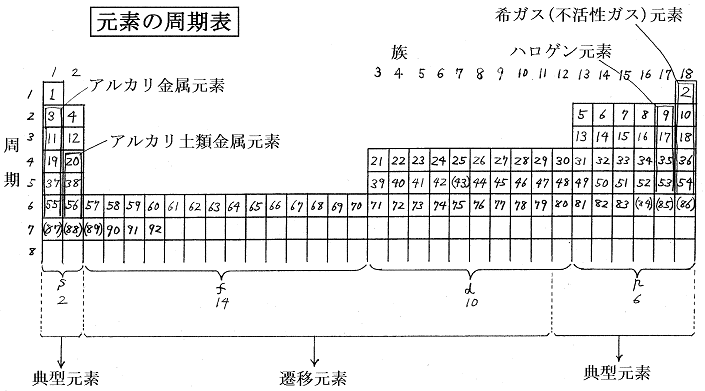
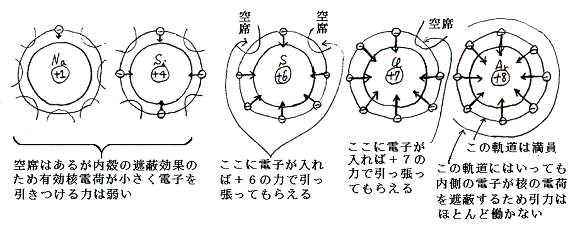
前項1.(3)の説明から明らかなように内殻にある電子は最外殻にある電子から見ると、そのすべての電荷が中心の原子核の位置にあるように見える。そのためその電荷は中心の原子核の正電荷を内殻に存在する電気量だけ打ち消してしまう。そのため最外殻の電子には下図の様にNaでは+1、Mgでは+2、・・・・Clでは+7の核電荷が中心に存在してそれに引かれているように見えることになる。(たとえば第3周期ならNa=+1、Mg=+2、Al=+3、等々・・・・下図参照)
そのとき同一周期だから最外殻の電子軌道の半径はほぼ同じだから原子番号の増大とともに最外殻の電子はより強く引きつけられる事になる。より正確に言うと電子軌道は見かけの中心電荷の増大により締め上げられてより縮まっており、その効果によっても、より強く引きつけられる。そのため同一周期の原子では族番号が増えるに従いイオン化エネルギーは増大する。そして原子半径は減少する。
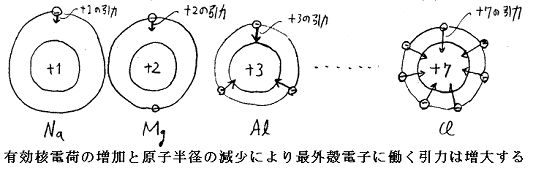
前項1.(3)の理由により核電荷が内殻の電子により遮蔽される。そのとき同一族元素故に、最外殻電子にとってすべて同じ核電荷が存在するように見える(たとえばアルカリ金属なら+1、アルカリ土類金属なら+2、等々・・・・下図参照)
このとき同一族故に有効核電荷は変わらないが、内殻を構成する電子数が増大しているので原子核から最外殻電子までの距離は原子番号とともに増大する。距離が大きくなるのでクーロンの電気的引力は原子番号の増大とともに減少する。そのために同一族元素ではイオン化エネルギーは原子番号とともに減少する。
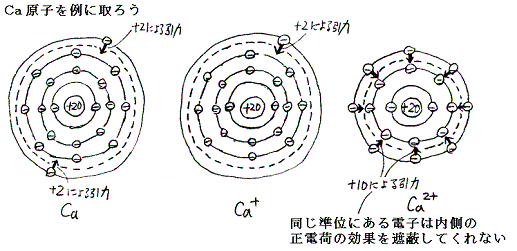
2つの電荷の間に働く電気力の大きさは電荷の積に比例するから、イオン化の段階がより高いイオンからさらに電子をはずそうとすると、当然イオン化エネルギーはより大きくなる。
電子親和力と言われるが、本当は電子親和エネルギーと言うべきもの。これは[中性の原子と一つの電子が離れて存在するときのエネルギー]と[中性の原子がその電子を内部に取り込んだ状態のエネルギー]との差である。
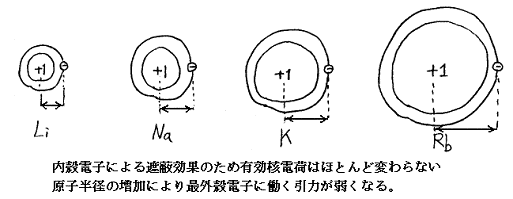
ここで注意すべき事は前者より後者の方がより安定化する(エネルギー的により低い状態)と言うことである。つまり中性原子でも電子を引きずり込む効果があるということである。このように中性原子が電子を引っ張り込む力があるということは一見すると不思議なことだが、これは1.(5)の効果によって生じる。つまり中性原子の外側にある電子を引きずり込む力はまったく働かないが、一旦原子の中に埋まり込むと引きずり込む力が働くのである。原子の中に電子が埋まり込むと、1.(3)の効果により、その電子と同列か、より外側にある電子雲の分布は中心の核電荷を遮蔽してくれないので、埋まり込んだ電子には中心の核電荷(正)と埋まり込んだ電子よりも内側の殻に存在する電子の電荷(負)の差に相当する正電荷による引力が働くのである。
前述の2.(3)の理由により、電子軌道に空席がある限り電子は中性原子の電子雲の中に埋まり込める。埋まり込みさえすれば1.(5)の効果により、安定化していく。しかし3.(1)に述べたように中心核電荷の内殻電子による遮蔽効果が族によって異なり、同一周期で比較すると、見かけの中心電荷はハロゲン元素が最大になる。同一周期の元素中ではハロゲン元素の電子親和力が最大になる。
希ガス(不活性ガス)の族では最外殻の電子軌道が一杯になっているので、余分な電子は既存の電子殻に埋まり込むことができず1.(5)の効果による引力の効果は期待できない。そのため希ガスは余分な電子を引きつけることはできない。
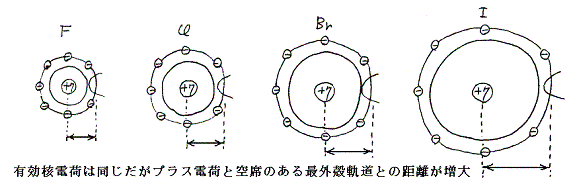
同一族だから最外殻の電子配置は同じ。ゆえに内殻の電子の電荷総量と原子核の電荷の差は同じになる。そのため最外殻電子に働く原子核の有効核電荷(内殻の電子による遮蔽の効果を差し引いたもの)は同じになる。しかし原子核と余分な電子が入り込める空席のある最外殻軌道との距離は原子番号と供に増大する。クーロン力は距離の2乗に反比例して弱くなるので、電子親和力も原子番号とともに弱まる。
最外殻の電子の定員が一杯になると、次の電子は、その外側の軌道にしか入れない。その場合は、それよりも内側の軌道の電子が原子核の正電荷を遮蔽してしまうので正電荷による引力を受けることができない。つまり中性の原子が引っ張り込める電子の最大数は、最外殻の空席の数までである。故にハロゲン族は−1価、酸素・イオウ族は−2価、窒素・リン族は−3価の負イオンにしかなれない。その価数までなら、中性原子と余分な電子がバラバラに離れて存在するよりも、くっついて負イオンとなって存在する方がエネルギー的により安定である。
水素は1族で有効核電荷は+1であるが、原子半径が小さいゆえに引力大でイオン化エネルギーと電子親和力はかなり大きくなる。ちょうど周期率表の並びで、真ん中当たりのケイ素と同じくらいになる。又K殻の定員は2個だから余分な電子を1つ受け入れれば閉殻となる。これが水素が1価の共有結合をつくる理由である。
核の正電荷が増えるとともに内殻のd軌道やf軌道に電子が増えていく。そのため最外殻のs軌道電子の受ける有効核電荷はあまり変わらない。しかも原子半径がよく似ているためイオン化エネルギーはほとんど変わらない。
 電子軌道はエネルギー差がほとんど無くひとまりまりになっている部分と電子軌道がまったく存在しないエネルギー域の部分に分かれている。ひとまとまりになっている電子軌道を眺めてみると、ひとまとまりの中で最もエネルギー準位が高いものは、どのまとまりにおいても、p軌道である。そしてこの軌道まで電子が満ちた状態が希ガスの電子配置である。(2.(4)殻を構成する電子軌道のエネルギー準位は電子が詰まっていくに従って分裂しながら安定化するを参照せよ)
電子軌道はエネルギー差がほとんど無くひとまりまりになっている部分と電子軌道がまったく存在しないエネルギー域の部分に分かれている。ひとまとまりになっている電子軌道を眺めてみると、ひとまとまりの中で最もエネルギー準位が高いものは、どのまとまりにおいても、p軌道である。そしてこの軌道まで電子が満ちた状態が希ガスの電子配置である。(2.(4)殻を構成する電子軌道のエネルギー準位は電子が詰まっていくに従って分裂しながら安定化するを参照せよ)
そのときエネルギー準位の値は原子の中心に存在する核(正電荷を持つ)からの距離に関係する。つまりエネルギー準位がひとまとまりになっている電子軌道上にはいっている電子群はほぼ同じ距離にあり、同一球面上にあると考えて良い。
そのとき1.(3)(5)から明らかな様に、同一球面上にある電子は、その球面上にある電子に働く核の正電荷による引力を遮蔽してくれない。だから同一球面(つまり同一軌道殻)に電子が詰まっていくにつれて中心核の正電荷は増えるのだが、そのふえた電荷でもってその球面上の電子はさらに強く核の方へ引きつけられる。だから同一球面がちょうど一杯になった希ガスの状態のイオン化エネルギーが極大を取る。
そして次に電子がはいる電子軌道はエネルギーギャップの大きく存在する電子軌道、つまりいままで電子が満たされていた球面よりもずっと外側にある球面上の軌道である。そしてその軌道に存在する電子に対しては、いままで電子が満たされてきた一つ内側の軌道に存在する電子が中心にふえた正電荷の引力を完全に遮蔽してくれるから+1の有効核電荷しか働かない。これがアルカリ金属のイオン化エネルギーが小さくなる理由である。3.(1)参照
電子親和力に於いてもエネルギーギャップが球殻状のエネルギー軌道間の距離を意味すると解釈すれば4.(1)により、ハロゲン原子の電子親和力が最大、アルカリ金属の電子親和力が最小、希ガスの電子親和力=0となることが理解できる。